50 mg, 70 mg pulver till koncentrat till infusionsvätska, lösning
kaspofungin
natrium
Du behöver ett recept för att kunna köpa denna vara. Om du har ett recept kan du handla genom att logga in med ditt bank-ID.
Läs alltid bipacksedeln innan användning.
EAN: 07046260060791
50 mg, 70 mg pulver till koncentrat till infusionsvätska, lösning
kaspofungin
natrium
Spara denna information, du kan behöva läsa den igen.
Om du har ytterligare frågor vänd dig till läkare, sjuksköterska eller apotekspersonal.
Om du får biverkningar, tala med läkare, sjuksköterska eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
Vad Cancidas är
Cancidas innehåller ett läkemedel som kallas kaspofungin. Det tillhör en grupp läkemedel som kallas antimykotikum (medel mot svamp).
Vad Cancidas används för
Cancidas används för att behandla följande infektioner hos barn, ungdomar och vuxna:
allvarliga svampinfektioner i vävnader eller organ (kallad "invasiv candidiasis"). Infektionen orsakas av svamp(jäst)celler som kallas Candida.
Personer som kan få den här typen av infektion inkluderar nyopererade patienter eller de med nedsatt immunförsvar. Feber och frossa som inte går över med antibiotikabehandling är de vanligaste symtomen vid denna typ av infektion.
svampinfektioner i näsan, bihålorna eller lungorna (kallad "invasiv apergillos") om andra medel mot svamp inte har haft förväntad effekt eller har orsakat biverkningar. Denna infektion orsakas av en organism som kallas Aspergillus.
Personer som kan få den här typen av infektion inkluderar de som behandlas med kemoterapi, de som har genomgått en transplantation och de med nedsatt immunförsvar.
misstänkta svampinfektioner om du har feber och lågt antal vita blodkroppar som inte går över med antibiotikabehandling. Personer med risk att få en svampinfektion inkluderar de som nyligen genomgått en operation eller de med nedsatt immunförsvar.
Hur Cancidas fungerar
Cancidas gör svampceller sköra och hindrar svampen från att växa ordentligt. Detta hindrar infektionen från att sprida sig och ger kroppens naturliga försvar en chans att helt göra sig av med infektionen.
om du är allergisk mot kaspofungin eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6).
Om du är osäker rådfråga läkare, sjuksköterska eller apotekspersonal innan du får ditt läkemedel.
Tala med läkare, sjuksköterska eller apotekspersonal innan du får Cancidas om:
om du är allergisk mot några andra läkemedel
om du någon gang har haft leverproblem - du kan behöva en annan dos av detta läkemedel
om du redan tar ciklosporin (hjälper till att förebygga avstötning av transplanterade organ eller för att undertrycka immunsystemet) - eftersom din läkare kan behöva ta ytterligare blodprover under din behandling.
om du någon gång haft andra medicinska problem
Om något av ovanstående stämmer in på dig (eller om du är osäker), tala med läkare, sjuksköterska eller apotekspersonal innan du får Cancidas.
Cancidas kan också orsaka allvarliga hudbiverkningar som Stevens-Johnson syndrom (SJS) och toxisk epidermal nekrolys (TEN).
Tala om för läkare, sjuksköterska eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel, även receptfria sådana eller naturläkemedel. Detta på grund av att Cancidas kan påverka sättet på hur andra läkemedel verkar. Andra läkemedel kan även påverka sättet på hur Cancidas verkar.
Tala om för läkare, sjuksköterska eller apotekspersonal om du tar något av följande läkemedel:
ciklosporin eller takrolimus (hjälper till att förebygga avstötning av transplanterade organ eller för att undertrycka immunsystemet) eftersom din läkare kan behöva ta ytterligare blodprover under din behandling
vissa läkemedel mot HIV som efavirenz eller nevirapin
fenytoin eller karbamazepin (används för behandling av kramper)
dexametason (kortisonpreparat)
rifampicin (ett antibiotikum).
Om något av ovanstående stämmer in på dig (eller om du är osäker), tala med läkare, sjuksköterska eller apotekspersonal innan du får Cancidas
Om du är gravid eller ammar eller tror att du kan vara gravid, rådfråga läkare innan du tar detta läkemedel.
Cancidas har inte studerats hos gravida kvinnor. Det bör endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för det ofödda barnet.
Kvinnor som får Cancidas bör inte amma.
Det finns ingen information som tyder på att Cancidas påverkar din förmåga att köra bil och handha maskiner
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per injektionsflaska, d.v.s. är näst intill “natriumfritt”.
Cancidas förbereds och ges alltid av professionell sjukvårdspersonal.
Du kommer få Cancidas:
en gång om dagen
med långsam injektion i en ven (intravenös infusion)
under ungefär 1 timme.
Din läkare kommer att bestämma längden av behandlingen och hur mycket Cancidas du kommer att få per dag. Din läkare kommer att kontrollera hur väl läkemedlet fungerar för dig. Om du väger mer än 80 kg kan du behöva en annan dos.
Dosen för barn och ungdomar kan skilja sig från dosen till vuxna.
Din läkare kommer att bestämma hur mycket Cancidas du behöver och längden av behandlingen per dag. Om du är orolig över att du fått för mycket Cancidas, tala med läkare eller sjuksköterska omedelbart.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, sjuksköterska eller apotekspersonal.
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Om du får någon av följande biverkningar, tala omedelbart med läkare eller sjuksköterska - du kan behöva akut sjukvårdsbehandling:
utslag, klåda, värmekänsla, svullnad av ansikte, läppar eller hals eller andningssvårigheter – du kan ha fått en histaminreaktion av läkemedlet.
andningssvårigheter med väsande ljud eller förvärring av befintliga utslag – du kan ha fått en allergisk reaktion av läkemedlet.
hosta, allvarliga andningssvårigheter – om du är vuxen och har invasiv aspergillos kan du få ett allvarligt andningsproblem som kan resultera i andningssvikt.
hudutslag, flagnande hud, sår på slemhinnorna, nässelutslag, stora områden med flagnande hud.
Som för alla receptbelagda läkemedel kan vissa biverkningar vara allvarliga. Fråga din läkare efter mer information.
Andra biverkningar hos vuxna inkluderar:
Vanliga: kan förekomma hos färre än 1 av 10 användare:
sänkt hemoglobin (minskad mängd syretransporterande ämne i blodet), minskat antal vita blodkroppar
lågt kalium i blodet
sänkt albumin (ett slags protein) i blodet, sänkt kalium eller låga kaliumnivåer i blodet
huvudvärk
inflammation i venen
andnöd
diarré, illamående eller kräkningar
forändrade värden för vissa blodanalyser (gäller även förhöjda värden på vissa leverprover)
klåda, utslag, hudrodnad eller ökad svettning
ledsmärta
frossa, feber,
klåda vid injektionsstället.
Mindre vanliga: kan förekomma hos färre än 1 av 100 användare:
förändrade värden för vissa blodanalyser (inklusive blodkoagulationssjukdomar, blodplättar, röda blodkroppar och vita blodkroppar)
minskad aptit, ökad mängd kroppsvätska, obalans i kroppens salthalt, höga blodsockernivåer i blodet, låga kalciumnivåer i blodet, förhöjda kalciumnivåer i blodet, låga magnesiumnivåer i blodet, ökade syrahalter i blodet
förvirring, nervös känsla, oförmåga att sova
känsla av yrsel, nedsatt känsel och känslighet (speciellt i huden), skakningar, känsla av trötthet, smakförändring, stickningar eller domningar
dimsyn, ökat tårmängd, svullna ögonlock, gulfärgning av ögonvitorna
känsla av snabba eller oregelbundna hjärtslag, snabba hjärtslag, oregelbundna hjärtslag, onormal hjärtrytm, hjärtsvikt
blodvallning, värmevallning, högt blodtryck, lågt blodtryck, rodnad utmed en ven som också är extremt öm vid beröring
åtstramning av musklerna runt luftvägarna som resulterar i väsande ljud eller hosta, snabb andhämtning, andfåddhet som väcker dig, syrebrist i blodet, onormala andningsljud, knarrande ljud i lungorna, väsande, nästäppa, hosta, halsont
buksmärta, smärta i övre delen av buken, väderspänning, , förstoppning, sväljsvårigheter, muntorrhet, dålig matsmältning, gaser, magbesvär, svullnad på grund av vätskeansamling kring buken
minskat gallflöde, leverförstoring, gulfärgning av hud och/eller ögonvitor, leverskada orsakad av läkemedel eller kemikalie, leverstörningar
onormal hudvävnad, generell klåda, nässelutslag, olika typer av hudutslag, onormal hud, röda och ofta kliande fläckar på armar och ben och ibland i ansiktet och på övriga kroppen
ryggsmärta, smärta i en arm eller ben, benvävnadssmärta, muskelsmärta, muskelsvaghet
nedsättning av njurfunktionen, plötslig nedsättning av njurfunktionen
smärta vid kateteringång, besvär vid injektionsstället (rodnad, förhårdnad, smärta, svullnad, irritation, utslag, nässelutslag, vätskeläckage från katetern in i vävnaden), inflammation i venen vid injektionsstället
förhöjt blodtryck och ändrade värden för vissa blodanalyser (inklusive njurelektrolyter och koagulationstest), förhöjda nivåer av läkemedlet du tar vilket försvagar immunförsvaret
bröstobehag, bröstsmärta, känsla av ändrad kroppstemperatur, allmän sjukdomskänsla, allmän smärta, svullnad av ansikte, svullnad av vrister, händer eller fötter, svullnad, ömhet, känsla av trötthet.
Ytterligare biverkningar hos barn och ungdomar
Mycket vanliga: kan förekomma hos fler än 1 av 10 användare:
feber
Vanliga: kan förekomma hos färre än 1 av 10 användare:
huvudvärk
snabb puls
blodvallning, lågt blodtryck
förändrade värden för vissa blodanalyser (förhöjda värden på vissa leverprover)
klåda, utslag
smärta vid kateterområdet
frossa
förändrade värden för vissa blodanalyser.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och flaskan (de två första siffrorna anger månaden, de följande fyra siffrorna anger året). Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2°C till 8°C).
Så snart Cancidas färdigställts bör den användas omedelbart. Detta på grund av att den inte innehåller några ämnen som stoppar bakterietillväxt. Endast utbildad sjukvårdspersonal som har läst hela bruksanvisningen bör färdigställa detta läkemedel (se nedan ”Instruktioner för att lösa upp och späda Cancidas”).
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Den aktiva substansen är kaspofungin.
Cancidas 50 mg pulver till koncentrat till infusionsvätska
Varje flaska Cancidas innehåller 50 mg kaspofungin.
Cancidas 70 mg pulver till koncentrat till infusionsvätska
Varje flaska Cancidas innehåller 70 mg kaspofungin.
Övriga innehållsämnen är sackaros, mannitol (E421), koncentrerad ättiksyra och natriumhydroxid (vänligen se avsnitt 2 Vad du behöver veta innan du får Cancidas).
Cancidas är ett sterilt, vitt till benvitt, kompakt pulver.
Varje förpackning innehåller en injektionsflaska med pulver.
Innehavare av godkännande för försäljning | Tillverkare |
Merck Sharp & Dohme B.V. Waarderweg 39 2031 BN Haarlem Nederländerna | Merck Sharp & Dohme B.V. Waarderweg 39 2031 BN Haarlem Nederländerna |
eller FAREVA Mirabel Route de Marsat-Riom 63963 Clermont-Ferrand Cedex 9 Frankrike |
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Belgique/België/Belgien MSD Belgium Tél/Tel: +32(0)27766211 dpoc_belux@msd.com | Lietuva UAB Merck Sharp & Dohme Tel.: +370 5 278 02 47 msd_lietuva@merck.com |
България Мерк Шарп и Доум България ЕООД Тел.: +359 2 819 3737 info-msdbg@merck.com | Luxembourg/Luxemburg MSD Belgium Tél/Tel: +32(0)27766211 dpoc_belux@msd.com |
Česká republika Merck Sharp & Dohme s.r.o. Tel.: +420 233 010 111 dpoc_czechslovak@merck.com | Magyarország MSD Pharma Hungary Kft. Tel.: +36 1 888 5300 hungary_msd@merck.com |
Danmark MSD Danmark ApS Tlf: +45 44 82 40 00 dkmail@merck.com | Malta Merck Sharp & Dohme Cyprus Limited Tel.: 8007 4433 (+ 356 99917558) malta_info@merck.com |
Deutschland MSD Sharp & Dohme GmbH Tel: 0800 673 673 673 (+49 (0) 89 4561 0) e-mail@msd.de | Nederland Merck Sharp & Dohme B.V. Tel: 0800 9999000 (+31 23 5153153) medicalinfo.nl@merck.com |
Eesti Merck Sharp & Dohme OÜ Tel.: +372 6144 200 msdeesti@merck.com | Norge MSD (Norge) AS Tlf: +47 32 20 73 00 msdnorge@msd.no |
Eλλάδα MSD Α.Φ.Β.Ε.Ε Τηλ: + 30 210 98 97 300 dpoc_greece@merck.com | Österreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 dpoc_austria@merck.com |
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd_info@merck.com | Polska MSD Polska Sp. z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
France MSD France Tél: + 33 (0) 1 80 46 40 40 | Portugal Merck Sharp & Dohme, Lda Tel: +351 21 4465700 inform_pt@merck.com |
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia_info@merck.com | România Merck Sharp & Dohme Romania S.R.L. Tel: + 4021 529 29 00 msdromania@merck.com |
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo_ireland@msd.com | Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: + 386 1 5204201 msd_slovenia@merck.com |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika Merck Sharp & Dohme, s. r. o. Tel.: +421 2 58282010 dpoc_czechslovak@merck.com |
Ιtalia MSD Italia S.r.l. Tel: 800 23 99 89 (+39 06 361911) medicalinformation.it@msd.com | Suomi/Finland MSD Finland Oy Puh/Tel: +358 (0) 9 804 650 info@msd.fi |
Κύπρος Merck Sharp & Dohme Cyprus Limited Τηλ.: 800 00 673 (+357 22866700) cyprus_info@merck.com | Sverige Merck Sharp & Dohme (Sweden) AB Tel: +46 (0)77 5700488 medicinskinfo@merck.com |
Latvija SIA Merck Sharp & Dohme Latvija Tel: +371 67364 224 msd_lv@merck.com | United Kingdom (Northern Ireland) Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfoNI@msd.com |
Denna bipacksedel ändrades senast: 04/2024
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu/.
Instruktioner för att lösa upp och späda CANCIDAS:
Upplösning av CANCIDAS
ANVÄND INTE SPÄDNINGSVÄTSKOR INNEHÅLLANDE GLUKOS, eftersom CANCIDAS inte är stabilt i spädningsvätskor innehållande glukos. BLANDA ELLER INFUNDERA INTE CANCIDAS MED NÅGRA ANDRA LÄKEMEDEL eftersom det inte finns data tillgängligt angående kompatibiliteten för CANCIDAS med andra intravenösa substanser, tillsatsämnen eller läkemedel. Kontrollera visuellt infusionslösningen med avseende på partiklar eller missfärgning.
CANCIDAS 50 mg pulver till koncentrat till infusionsvätska
INSTRUKTION FÖR BEREDNING AV INFUSIONSLÖSNING TILL VUXNA
(50 mg injektionsflaska)
Steg 1 Beredning i konventionell injektionsflaska
F�ör att lösa upp pulvret, låt injektionsflaskan anta rumstemperatur och tillsätt aseptiskt 10,5 ml vatten för injektionsvätskor. Koncentrationerna i de upplösta injektionsflaskorna blir 5,2 mg/ml.
Det vita till benvita kompakta frystorkade pulvret kommer att upplösas helt. Blanda varsamt tills en klar lösning erhålls. Kontrollera visuellt den färdiga lösningen med avseende på partiklar eller missfärgningar. Den färdiga lösningen kan förvaras upp till 24 timmar vid förvaring i 25ºC eller lägre.
Steg 2 Tillsättning av upplöst CANCIDAS till infusionslösning för patient
Spädningsvätskor till den slutgiltiga infusionslösningen är: natriumklorid injektionsvätska eller lakterad Ringerlösning. Infusionslösningen färdigställs genom att aseptiskt tillsätta den rätta mängden upplöst koncentrat (enligt tabellen nedan) till en 250 ml infusionspåse eller flaska. Reducerad infusionsvolym om 100 ml kan användas, om medicinskt nödvändigt, till doserna 50 mg eller 35 mg dagligen. Använd ej om lösningen är grumlig eller har fällningar.
50 mg INJEKTIONSFLASKA:
FÄRDIGSTÄLLANDE AV INFUSIONSLÖSNING TILL VUXNA
DOS* | Volym upplöst CANCIDAS för överföring till infusionspåse eller flaska | Standardberedning (upplöst CANCIDAS tillsatt till 250 ml) slutlig koncentration | Reducerad infusionsvolym (upplöst CANCIDAS tillsatt till 100 ml) slutlig koncentration |
50 mg | 10 ml | 0,20 mg/ml | - |
50 mg vid reducerad volym | 10 ml | - | 0,47 mg/ml |
35 mg för måttlig leverfunktions-nedsättning (från en 50 mg injektionsflaska) | 7 ml | 0,14 mg/ml | - |
35 mg för måttlig leverfunktions-nedsättning (från en 50 mg injektionsflaska) vid reducerad volym | 7 ml | - | 0,34 mg/ml |
* 10,5 ml bör alltid användas för beredning i injektionsflaskor.
INSTRUKTION FÖR BEREDNING AV INFUSIONSLÖSNING TILL BARN
(50 mg injektionsflaska)
Beräkning av kroppsyta för dosering till barn
Innan beredning av infusionslösning, beräkna patientens kroppsyta enligt följande formel (Mosteller´s formel):
Kroppsyta (m2) = | 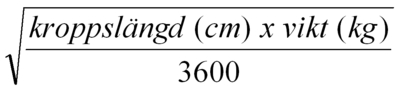 |
Beredning av 70 mg/m2 infusionslösning till barn >3 månaders ålder (med en 50 mg injektionsflaska)
1. Fastställ den aktuella engångsbolusdosen för behandling av barnet med hjälp av patientens beräknade kroppsyta (enligt formel ovan) och följande ekvation:
Kroppsyta (m2) ×70 mg/m2 = engångsbolusdos
Maximal engångsbolusdos dag 1 ska ej överstiga 70 mg oavsett patientens beräknade dos.
2. Låt injektionsflaskan med CANCIDAS anta rumstemperatur.
3. Tillsätt aseptiskt 10,5 ml vatten för injektionvätskor.a Detta upplösta koncentrat kan förvaras upp till 24 timmar vid förvaring i 25 ºC eller lägre.b Den slutliga koncentrationen av kaspofungin i injektionsflaskan blir 5,2 mg/ml.
4. Ta ut mängden läkemedel motsvarande den beräknade engångsbolusdosen (steg 1) från injektionsflaskan. Överför aseptiskt denna mängd (ml)c av upplöst koncentrat av CANCIDAS till en 250 ml infusionspåse (eller flaska) med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning. Alternativt kan mängden (ml)c upplöst koncentrat av CANCIDAS tillsättas till en reducerad infusionsvolym med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning, ej överstigande en slutlig koncentration om 0,5 mg/ml. Denna infusionslösning ska användas inom 24 timmar vid förvaring i 25ºC eller lägre, eller inom 48 timmar vid kylförvaring 2ºC till 8ºC.
Beredning av 50 mg/m2 infusionslösning till barn >3 månaders ålder (med en 50 mg injektionsflaska)
1. Fastställ den aktuella dagliga underhållsdosen för behandling av barnet med hjälp av patientens beräknade kroppsyta (enligt formel ovan) och följande ekvation:
Kroppsyta (m2) × 50 mg/m2 = daglig underhållsdos
Den dagliga underhållsdosen ska ej överstiga 70 mg oavsett patientens beräknade dos.
2. Låt injektionsflaskan med CANCIDAS anta rumstemperatur.
3. Tillsätt aseptiskt 10,5 ml vatten för injektionsvätskor.a Detta upplösta koncentrat kan förvaras upp till 24 timmar vid förvaring i 25 ºC eller lägre.b Den slutliga koncentrationen av kaspofungin i injektionsflaskan blir 5,2 mg/ml.
4. Ta ut mängden läkemedel motsvarande den beräknade dagliga underhållsdosen (steg 1) från injektionsflaskan. Överför aseptiskt denna mängd (ml)c av upplöst koncentrat av CANCIDAS till en 250 ml infusionspåse (eller flaska) med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning. Alternativt kan mängden (ml)c upplöst koncentrat av CANCIDAS tillsättas till en reducerad infusionsvolym med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning, ej överstigande en slutlig koncentration om 0,5 mg/ml. Denna infusionslösning ska användas inom 24 timmar vid förvaring i 25ºC eller lägre, eller inom 48 timmar vid kylförvaring 2ºC till 8ºC.
Noteringar för beredning
|
CANCIDAS 70 mg pulver till koncentrat till infusionsvätska
INSTRUKTION FÖR BEREDNING AV INFUSIONSLÖSNING TILL VUXNA
(70 mg injektionsflaska)
Steg 1 Beredning i konventionell injektionsflaska
För att lösa upp pulvret, låt injektionsflaskan anta rumstemperatur och tillsätt aseptiskt 10,5 ml vatten för injektionsvätskor. Koncentrationerna i de upplösta injektionsflaskorna blir 7,2 mg/ml.
Det vita till benvita kompakta frystorkade pulvret kommer att upplösas helt. Blanda varsamt tills en klar lösning erhålls. Kontrollera visuellt den färdiga lösningen med avseende på partiklar eller missfärgningar. Den färdiga lösningen kan förvaras upp till 24 timmar vid förvaring i 25°C eller lägre.
Steg 2 Tillsättning av upplöst CANCIDAS till infusionslösning för patient
Spädningsvätskor till den slutgiltiga infusionslösningen är: natriumklorid injektionsvätska eller lakterad Ringerlösning. Infusionslösningen färdigställs genom att aseptiskt tillsätta den rätta mängden upplöst koncentrat (enligt tabellen nedan) till en 250 ml infusionspåse eller flaska. Reducerad infusionsvolym om 100 ml kan användas, om medicinskt nödvändigt, till doserna 50 mg eller 35 mg dagligen. Använd ej om lösningen är grumlig eller har fällningar.
70 mg INJEKTIONSFLASKA:
FÄRDIGSTÄLLANDE AV INFUSIONSLÖSNING TILL VUXNA
DOS* | Volym upplöst CANCIDAS för överföring till infusionspåse eller flaska | Standardberedning (upplöst CANCIDAS tillsatt till 250 ml) slutlig koncentration | Reducerad infusionsvolym (upplöst CANCIDAS tillsatt till 100 ml) slutlig koncentration |
70 mg | 10 ml | 0,28 mg/ml | Rekommenderas ej |
70 mg (från två 50 mg injektionsflaskor)** | 14 ml | 0,28 mg/ml | Rekommenderas ej |
35 mg för måttlig leverfunktions-nedsättning (från en 70 mg injektionsflaska) | 5 ml | 0,14 mg/ml | 0,34 mg/ml |
* 10,5 ml bör alltid användas för beredning i injektionsflaskor
**Om 70 mg injektionsflaska inte finns tillgänglig kan dosen 70 mg färdigställas utifrån två 50 mg injektionsflaskor
INSTRUKTION FÖR BEREDNING AV INFUSIONSLÖSNING TILL BARN
(70 mg injektionsflaska)
Beräkning av kroppsyta för dosering till barn
Innan beredning av infusionslösning, beräkna patientens kroppsyta enligt följande formel (Mosteller´s formel):
Kroppsyta (m2) = | 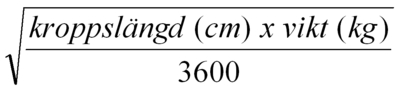 |
Beredning av 70 mg/m2 infusionslösning till barn >3 månaders ålder (med en 70 mg injektionsflaska)
1. Fastställ den aktuella engångsbolusdosen för behandling av barnet med hjälp av patientens beräknade kroppsyta (enligt formel ovan) och följande ekvation:
Kroppsyta (m2) X 70 mg/m2 = engångsbolusdos
Maximal engångsbolusdos dag 1 ska ej överstiga 70 mg oavsett patientens beräknade dos.
2. Låt injektionsflaskan med CANCIDAS anta rumstemperatur.
3. Tillsätt aseptiskt 10,5 ml vatten för injektionsvätskor.a Detta upplösta koncentrat kan förvaras upp till 24 timmar vid förvaring i 25°C eller lägre.b Den slutliga koncentrationen av kaspofungin i injektionsflaskan blir 7,2 mg/ml.
4. Ta ut mängden läkemedel motsvarande den beräknade engångsbolusdosen (steg 1) från injektionsflaskan. Överför aseptiskt denna mängd (ml)c av upplöst koncentrat av CANCIDAS till en 250 ml infusionspåse (eller flaska) med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning. Alternativt kan mängden (ml)c upplöst koncentrat av CANCIDAS tillsättas till en reducerad infusionsvolym med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning, ej överstigande en slutlig koncentration om 0,5 mg/ml. Denna infusionslösning ska användas inom 24 timmar vid förvaring i 25°C eller lägre, eller inom 48 timmar vid kylförvaring 2°C till 8°C.
Beredning av 50 mg/m2 infusionslösning till barn >3 månaders ålder (med en 70 mg injektionsflaska)
1. Fastställ den aktuella dagliga underhållsdosen för behandling av barnet med hjälp av patientens beräknade kroppsyta (enligt formel ovan) och följande ekvation:
Kroppsyta (m2) X 50 mg/m2 = daglig underhållsdos
Den dagliga underhållsdosen ska ej överstiga 70 mg oavsett patientens beräknade dos.
2. Låt injektionsflaskan med CANCIDAS anta rumstemperatur.
3. Tillsätt aseptiskt 10,5 ml vatten för injektionsvätskor.a Detta upplösta koncentrat kan förvaras upp till 24 timmar vid förvaring i 25°C eller lägre.b Den slutliga koncentrationen av kaspofungin i injektionsflaskan blir 7,2 mg/ml.
4. Ta ut mängden läkemedel motsvarande den beräknade dagliga underhållsdosen (steg 1) från injektionsflaskan. Överför aseptiskt denna mängd (ml)c av upplöst koncentrat av CANCIDAS till en 250 ml infusionspåse (eller flaska) med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning. Alternativt kan mängden (ml)c upplöst koncentrat av CANCIDAS tillsättas till en reducerad infusionsvolym med natriumkloridlösning 0,9%, 0,45% eller 0,225% för infusion eller lakterad Ringerlösning, ej överstigande en slutlig koncentration om 0,5 mg/ml. Denna infusionslösning ska användas inom 24 timmar vid förvaring i 25°C eller lägre, eller inom 48 timmar vid kylförvaring 2°C till 8°C.
Noteringar för beredning
|