9,45 mg Implantat
buserelin
Du behöver ett recept för att kunna köpa denna vara. Om du har ett recept kan du handla genom att logga in med ditt bank-ID.
Läs alltid bipacksedeln innan användning.
9,45 mg Implantat
buserelin
Spara denna information, du kan behöva läsa den igen.
Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
Vad Suprefact Depot är
Suprefact Depot innehåller ett läkemedel som kallas för buserelin. Buserelin liknar ett naturligt förekommande hormon som frisätts av hjärnan. Det tillhör en grupp av läkemedel som kallas för ”luteiniserande hormon frisättande hormonanaloger” (LHRH-analoger).
Hur Suprefact Depot fungerar
Suprefact Depot verkar genom att sänka mängden hormoner som främjar tillväxten av tumörer i prostata. Prostatan är en körtel som ligger inunder blåsan hos män.
Vad Suprefact Depot används för
Suprefact Depot används vid behandling av avancerad prostatacancer.
Om du är allergisk mot buserelin eller något av övriga LHRH-analoger (t ex leuprolid, goserelin, triptorelin) eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6). Tecken på en allergisk reaktion inkluderar: utslag, svälj- eller andningssvårigheter, uppsvullnad av läppar, ansikte, svalg eller tunga.
Använd inte detta läkemedel om något av ovanstående stämmer in på dig. Vid osäkerhet ska du tala med läkare eller apotekspersonal innan du påbörjar din behandling med Suprefact Depot.
Tala med läkare eller apotekspersonal innan du påbörjar behandling med Suprefact Depot:
Om du fått dina testiklar bortopererade.
Om din cancer har spridits (metastatisk cancer). Initialt är det viktigt att du använder andra läkemedel för att sänka nivåerna av vissa andra hormoner. Detta kan dock ge upphov till tumörsmärta. Om detta inträffar ska du fråga din läkare eller apotekspersonal om råd.
Om du har problem med vattenkastning (urinering).
Om du har riskfakorer för hjärt-kärl sjukdom eller diabetes.
Om du har någon hjärtkärlsjukdom inklusive hjärtrytmrubbningar (arytmi), eller behandlas med läkemedel mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd vid användning av Suprefact Depot.
Om du har diabetes. Kontrollera dina blodsockernivåer regelbundet. Detta för att Suprefact Depot kan påverka din metabolism och därmed dina blodsockernivåer.
Om du har högt blodtryck. Din läkare eller sjuksköterska ska regelbundet kontrollera ditt blodtryck eftersom blodtrycket kan påverkas av Suprefact Depot.
Om du någon gång haft en depression. Du ska vara vaksam på din mentala hälsa eftersom det finns en risk att din depression kan komma tillbaka eller förvärras.
Om du har ett minskat antal röda blodkroppar eller om du upplever ökad trötthet (anemi).
Om du är osäker på om något av ovanstående stämmer in på dig ska du tala med läkare eller apotekspersonal innan du börjar använda Suprefact Depot.
Din läkare ska ombesörja att din bentäthet kontrolleras och kan förskriva lämplig behandling. Detta på grund av att LHRH-analoger kan orsaka en minskad bentäthet, osteoporos (försvagning av skelettet) och en ökad risk för benfrakturer, särskilt om du har riskfaktorer för benskörhet såsom kroniskt alkoholmissbruk, om du är rökare, förekomst av benskörhet i släkten eller om du under en längre tid behandlats med medel mot epilepsi eller med kortison.
Depression, som kan vara allvarlig, har rapporterats hos patienter som tar Suprefact Depot. Informera din läkare om du blir nedstämd/deprimerad under tiden du tar Suprefact Depot.
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel. Detta på grund av att Suprefact Depot kan påverka vissa läkemedels funktion. Vissa andra läkemedel kan också påverka funktionen av Suprefact Depot.
Tala med din läkare särskilt:
Om du använder läkemedel för diabetes. Detta på grund av att Suprefact Depot kan påverka hur dessa läkemedel fungerar vilket kan leda till att din diabetes förvärras.
Om du använder läkemedel för att behandla hjärtrytmrubbningar (t ex kinidin, prokainamid, amiodaron och sotalol).
Om du använder vissa andra läkemedel som kan öka risken för hjärtrytmrubbningar, när de används med Suprefact Depot (t ex metadon (används som smärtlindrande och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (som används vid svåra psykiska sjukdomar).
Suprefact Depot är ett läkemedel som endast ges till män. Det ska ej ges till kvinnor.
Du kan känna av biverkningar efter användning av detta läkemedel. Vissa av dessa biverkningar (såsom yrsel) kan påverka din koncentrationsförmåga och reaktionshastighet. Om detta inträffar ska du iaktta försiktighet vid bilkörning, vid hantering av verktyg eller av maskiner eller vid arbete som kräver hög uppmärksamhetsgrad.
Innehållet i en förfylld spruta (3 stavformade implantat som ger en dos om 9,45 mg buserelin) injiceras under huden (subkutant) i magområdet var tredje månad. Detta kan utökas med ytterligare tre veckor.
Injektionsområdet kommer att rengöras. Injektionen ges vanligen av en läkare eller sjuksköterska. Lokalbedövning kan ges för att lindra smärtan vid injektionen av implantaten.
Följ läkarens råd om när du ska ha Suprefact Depot och hur lång tid som ska gå mellan varje injektion.
Blodprover
Din läkare kommer att ta regelbunda blodprover på dig för att kontrollera hur behandlingen fungerar.
Det är inte troligt att din läkare eller sjuksköterska kommer att ge dig en för stor mängd läkemedel. För stora mängder av detta läkemedel kan göra att du känner dig svag, orolig, yr eller sjuk (illamående). Du kan även känna av huvudvärk, värmevallningar, magsmärta, svullnad (ödem) av anklar och nedre delen av benen, ömhet i brösten eller reaktioner vid injektionsområdet. Din läkare kan ge dig lämplig behandling mot dessa biverkningar.
Om du har ytterligare frågor om detta läkemedel,kontakta läkare, apotekspersonal eller sjuksköterska.
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem. Det är viktigt att du informerar din läkare innan nästa behandling om du känner av några biverkningar.
Om du upplever en allvarlig allergisk reaktion såsom andningssvårigheter eller chock ska du omedelbart kontakta din läkare eftersom det kan bli nödvändigt att ta bort implantatet.
Biverkningar som kan uppkomma initialt vid din behandling
I början av behandlingen kan mängden könshormoner som din kropp producerar komma att öka och du kan känna av en övergående symtomförsämring. Du kan till exempel lida av bensmärta, muskelsvagehet i benen, problem vid vattenkastning, vätskeansamling eller blodproppar i lungorna. Vanligtvis kommer du att ges en annan medicin, t ex cyproteronacetat, för att förhindra detta. Denna medicin måste du fortsätta att ta 3-4 veckor efter att du fått Suprefact Depot. Efter denna tidsperiod har testosteronnivåerna vanligtvis sjunkit till önskad nivå som resultat av buserelinbehandlingen.
Tala om för din läkare eller apotekspersonal om några av följande biverkningar blir allvarliga eller varar längre än några dagar:
Vanliga (kan förekomma hos upp till 1 av 10 användare)
Minskad sexlust (libido)
Impotens
Huvudvärk
Värmevallningar
Testikelförtvining (s k ”testikulär atrofi”)
Smärta eller andra lokala reaktioner vid injektionsområdet (såsom rodnad eller svullnad)
Humörförändringar, depression (långtidsbehandling)
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
Allergiska reaktioner såsom hudutslag som kan vara rött och kliande (inklusive nässelfeber)
Känsla av dåsighet eller trötthet
Känsla av yrsel
Förstoppning
Förstoring av bröstkörtlarna
Vätskeansamling (ödem) runt anklar och vader
Påverkan på vissa blodtester p g a ökning av enzymer producerade i din lever
Viktförändring
Humörförändringar, depression (korttidsbehandling)
Sällsynta (kan förekomma hos upp till 1 av 1000 användare)
Allvarliga allergiska reaktioner såsom andningssvårigheter
Känsla av oro, stress, känslomässigt instabilitet. Även sömnsvårigheter och minnes- eller koncentrationsstörningar
Snabba eller ojämna hjärtslag (palpitationer), förhöjt blodtryck hos personer med redan för högt blodtryck (hypertension)
Sjukdomskänsla (illamående), sjukdom (kräkning) eller diarré
Förändrad huvud- eller kroppsbehåring
Påverkan på vissa blodtester p g a förändringar i blodlipider och bilirubinökning
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 användare)
Allvarliga allergiska reaktioner med chock
Ökad törst, aptitförändringar, minskad glukostolerans (hos diabetiker kan detta leda till en försämrad diabetisk kontroll)
Öronsusningar (tinnitus), hörselstörningar
Förändringar i synförmågan såsom dimsyn och känsla av tryck bakom ögonen
Obehag eller smärta i muskulatur eller skelett
Försämring av allmänt välbefinnande
Minskat antal blodkroppar vilket kan leda till avvikande blodtester och eller blånad.
Förstoring av godartad tumör i hypofysen eller övergående ökning av tumörsmärta
Har rapporterats (förekommer hos ett okänt antal användare):
förändringar (QT-förlängning) som kan ses på elektrokardiogram (EKG)
Avvikande hudupplevelser som stickningar har observerats för andra formuleringar av buserelin.
Denna grupp av läkemedel (s k LHRH-agonister) kan orsaka en minskad bentäthet, osteoporos samt en ökad risk för benfrakturer. Risken för benfrakturer ökar med behandlingstidens längd. LHRH agoister kan öka risken för hjärtkärlsjukdom (såsom hjärtinfarkt och stroke), diabetes eller anemi (minskat antal röda blodkroppar vilket gör dig trött).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 30 ºC.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Den aktiva substansen i Suprefact Depot är buserelin. Varje förfylld spruta innehåller tre stavformade implantat vilket ger en dos av 9,9 mg buserelinacetat. Detta är motsvarande 9,45 mg buserelin. Övriga innehållsämnen är Poly (D,L-laktid-co-glykolid) med en kvot för laktid:glykolid av 75:25.
En förpackning innehåller 1 eller 2 sterila förfyllda injektionssprutor. Varje spruta innehåller tre krämfärgade stavformade implantat.
Innehavare av godkännande för försäljning
CHEPLAPHARM Arzneimittel GmbH, Ziegelhof 24, 17489 Greifswald, Tyskland
Tillverkare
Sanofi-Aventis Deutschland GmbH, Industriepark Höchst, (Bruningstrasse 50), 65926 Frankfurt am Main, Tyskland
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Österrike : Suprefact Depot - Implantat Für 3 Monate
Belgien: Suprefact Depot 9.45 mg Implant
Danmark : Suprefact Depot
Finland : Suprefact Depot 9.45 mg implantaatti
Frankrike: Trigonist 9.45 mg implant pour voie sous-cutanée
Tyskland: Profact Depot 9,45 mg 3-Monatsimplantat
Italien: Suprefact depot 3 Mesi
Luxemburg: Suprefact Depot 9.45 mg Implant
Nederländerna: Suprefact Depot 3 Maanden, implantatiestift 9.45 mg
Portugal : Suprefact Depot 3 Meses
Spanien: Suprefact Depot 9.45 mg Implante Subcutaneo
Sverige: Suprefact Depot 9.45 mg implantat
Storbritannien: Suprefact Depot 9.45 mg implant, for subcutaneous route
Denna bipacksedel ändrades senast: 2020-09-17
Ytterligare information om detta läkemedel finns på Läkemedelsverkets webbplats www.lakemedelsverket.se
1. LÄKEMEDLETS NAMN
Suprefact Depot 9.45 mg implantat, för subkutan administrering
2. DOSERING OCH ADMINISTRERINGSSÄTT
En spruta innehåller 3 implantatstavar och injiceras under huden i buken var tredje månad. Det är viktigt att intervallet om tre månader bibehålls, dock kan injektionsintervallet tillfälligt utökas med upp till tre veckor. Ett lokalanestetikum kan ges innan injektionen.
Observera: För att förhindra att implantatstavarna faller ut ur kanylen (A), håll applikatorn lodrätt med kanylen riktad uppåt till omedelbart före injektionen.
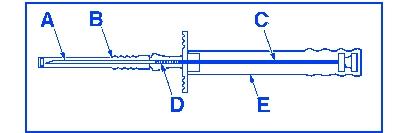
Kanyl
Skyddskåpa för nålen
Kolvstång
Implantat
Skyddshylsa för kolvstången
Efter att ha öppnat förpackningen och tagit fram applikatorn ur höljet, kontrollera att implantatstavarna befinner sig i fönstret på handtaget. Om nödvändigt, slå lätt med fingret på skyddskåpan vid kanylen för att återplacera dem i fönstret. Applikatorn ska användas omedelbart efter att förpackningen öppnats.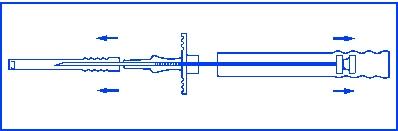
Desinficera injektionsstället i området vid sidan om bukväggen. Avlägsna först kolvstångens skyddshylsa (E), avlägsna därefter injektionskanylens skyddskåpa (B).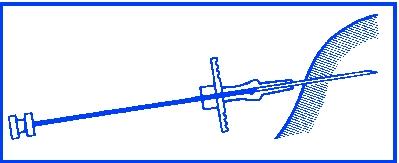
Lyft upp huden och för in kanylen ca 3 cm i underhudsvävnaden, håll applikatorn i horisontalläge eller med spetsen lätt pekande uppåt ända tills omedelbart före injektionen. Dra tillbaka applikatorn 1-2 cm före injektionen av implantatstavarna.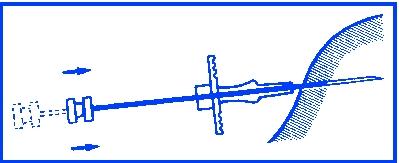
För in implantatstavarna i underhudsvävnaden genom att helt skjuta in kolvstången. Tryck ihop injektionkanalen, samtidigt som kanylen dras tillbaka så att implantatstavarna hålls på plats i vävnaden.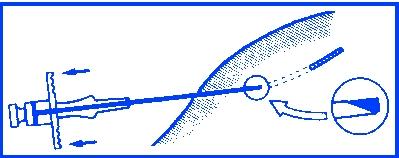
För att förvissa sig om att de tre implantatstavarna har injicerats, kontrollera att toppen av kolvstången syns på kanylens spets.
Det rekommenderas att en adjuvantiv behandling med en antiandrogen påbörjas ca 5 dagar innan behandlingen med Suprefact Depot inleds.
3. FARMACEUTISKA UPPGIFTER
3.1 Förteckning över hjälpämnen
Poly (D,L-laktid-co-glykolid)
3.2 Inkompatibiliteter
Ej tillämpligt, eftersom produkten föreligger i en speciell applikator.
3.3 Hållbarhet
3 år
3.4 Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förvaras vid högst 30 °C.
3.5 Förpackningstyp och innehåll
Förfylld spruta innehållande stavformade implantat bestående av tre stavar i en engångsapplikator tillverkad av cellulosapropionat och rostfritt stål förseglad i en påse gjord av polyetylenteraftalataluminium, LDPE-folie.
Förpackningsstorlekar: 1 eller 2 förfyllda sprutor per förpackning.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.